Внутрішня енергія тіл. Два способи зміни внутрішньої енергії
Внутрішня енергія тіл. Два способи зміни внутрішньої енергії
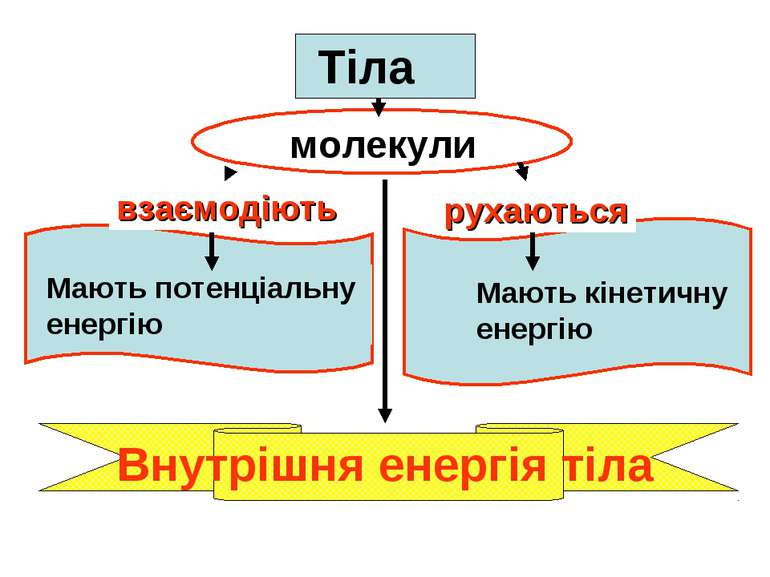
Внутрішня енергія — це сума кінетичної енергії хаотичного руху молекул і потенціальної енергії взаємодії молекул одна з одною. Внутрішня енергія — функція стану U = f(T).
У термодинаміці розглядають зміну внутрішньої енергії при переході з одного стану в інший. Величини, що визначають стан газу: Р, Т, V.
Найпростіше можна обчислити внутрішню енергію ідеального одноатомного газу, бо його молекули здійснюють лише поступальний рух. Зміна внутрішньої енергії даної маси ідеального газу відбувається лише за зміни його температури:

Якими способами можна змінити внутрішню енергію тіла? Обговорення дослідів.
Висновки узагальнюємо у вигляді таблиці.

• Внутрішня енергія макроскопічного тіла (U) є сумою кінетичної енергії хаотичного руху молекул (атомів) і потенціальної енергії їх взаємодії.
• Внутрішня енергія одноатомного ідеального газу:

де m — маса газу; М — молярна маса газу; R — універсальна газова стала; NA — стала Авогадро.
Робота термодинамічного процесу
Демонстрація дослідів та їх пояснення1. Ізобарний процес; р = const, А = pΔV.
Якщо газ стискався, то ΔV < 0 — робота газу негативна; якщо розширювався, то ΔV >0 — робота позитивна.
Робота зовнішніх сил матиме протилежний знак:


Робота чисельно дорівнює площі під кривою, яка описує процес на (p,V) діаграмі. Величина роботи залежить від того, яким шляхом виконувався перехід з початкового стану в кінцевий.
2. Самостійна робота з графіками ізопроцесів
Побудувати графіки ізотермічного та ізохорного процесів у координатах (p,V) та вказати, чому дорівнює робота для кожного випадку.
Висновки: ізотермічний процес (Т = const): робота дорівнює площі фігури, обмеженої ізотермою та двома ізохорами.
Ізохорний процес (V = const): А = 0.
Перший закон термодинаміки
Ідею про збереження енергії у природі висловлювали ще давньогрецькі філософи. Вони вважали, що в природі, яка нас оточує, весь час відбуваються зміни, які не можуть ніколи припинитися.У 40-х роках XIX ст. сталася важлива подія в історії фізики — було встановлено закон збереження та перетворення енергії.
Давайте пригадаємо цей закон. Енергія в природі не виникає з нічого й нікуди не зникає, вона лише переходить з однієї форми в іншу.
У який спосіб можна змінити внутрішню енергію тіла?
Внутрішню енергію можна змінити двома способами: виконанням роботи і теплопередачею.
Учитель. Отже, робота А — це міра зміни механічної енергії, кількість теплоти Q — міра зміни внутрішньої енергії, тобто способи зміни внутрішньої енергії еквівалентні. Тому відомий закон збереження енергії для механічних процесів поширюється і на теплові процеси.
Як математично можна записати причинну обумовленість скінченої зміни стану тіла (чи системи) зовнішніми механічними і тепловими впливами?

Це рівняння виражає закон збереження і перетворення енергії для теплових процесів, він дістав назву першого закону (начала) термодинаміки:
Зміна внутрішньої енергії термодинамічної системи дорівнює сумі роботи зовнішніх сил і наданої системи кількості теплоти.
Але можна розглядати і роботу А, виконану системою над зовнішніми тілами; тоді її записують із знаком «-» і рівняння набуває вигляду:

Інше формулювання першого закону термодинаміки: кількість теплоти, підведена до системи, частково йде на збільшення її внутрішньої енергії і частково на виконання системою роботи над зовнішніми тілами.
Назва процесу
|
Постійний параметр
|
Значення роботи, А’
|
Зміна внутрішньої енергії, ΔU
|
Запис першого закону термодинаміки
|
Формулювання першого закону термодинаміки
|
Ізобарвний
|
р = const
|
А' ≠ 0
|
ΔU ≠ 0
|
Q = ΔU + A'
| Кількість теплоти, отримана газом, іде на зміну його внутрішньої енергії і на виконання цим газом роботи |
Ізохорний
|
V = const
|
А ≠ О
|
ΔU = 0
|
Q = A’
| Кількість теплоти, отримана газом, іде на виконання цим газом роботи |
Ізотермічний
|
Т = const
|
А' ≠ 0
|
ΔU = 0
|
Q = A’
| Уся отримана газом кількість теплоти іде на виконання цим газом роботи |
Адіабатний
|
Q = const
|
А' ≠ 0
|
ΔU ≠ 0
|
ΔU = -А’
| Зміна внутрішньої енергії дорівнює роботі газу, взятої із протилежним знаком |

+
ОтветитьУдалить